引言
多能量计算机断层扫描(CT)是指利用光谱数据来区分和分类组织,以获取特定材料的图像。这是可能的,因为X射线光子的衰减是与能量相关的,每种物质都有特定的衰减曲线。
在双能量CT中,通过将组织暴露于两个不同的X射线光谱或使用具有两个不同能量范围的组合探测器,可以区分材料。这些双能量数据的分析技术提供了与组织对不同能量X射线的响应变化相关的信息。因此,利用两种不同的X射线光谱,材料区分和元素分解变得可行。
这种技术的一个缺点是,具有相似衰减曲线的材料无法被区分。多能量成像通过采用对能量敏感的光子计数设备,揭示了衰减曲线的额外定量信息。除了双能量CT之外,多能量CT还允许对多个高原子序数(Z值)元素进行光谱分解。
在临床实践中,双源CT的引入重新激活了双能量CT。两个不同光谱的同时获取,解决了由于时间变化引起的图像共配准问题。因此,对比增强变化和/或空间误匹配问题可以得到解决。其他方法是通过快速kV切换或能量敏感探测器引入的。
基于材料的区分或定量,已有多种与临床相关的双能CT应用得以确立。例如,材料区分可以分离低原子序数和高原子序数的材料,这对骨骼去除的后处理技术(如钙和碘的区分)或尿结石分析(如区分含有尿酸的尿结石和其他结石类型)有重要影响。材料定量则允许重建虚拟非增强影像,将碘含量从增强影像中减去。用虚拟非增强影像替代非对比增强影像,显示出能够通过省略标准的对比前数据采集,减少患者的辐射暴露。这些影像策略在血管成像、肝脏或肾脏成像中都能发挥重要作用,不仅能降低辐射,还能量化碘摄取。关于心脏成像,碘定量有望为冠状动脉形态分析增加心肌血供的信息。在肺动脉造影中,可以清楚地描绘出阻塞性肺疾病和肺栓塞,从而最优地评估肺灌注。除了肺灌注外,吸入的氙气定量也能准确评估动态和静态的区域通气。
材料分布和成分的数据提供的信息超出了或者补充了形态学CT。因此,我们希望将双能和多能成像视为一种“功能成像”的方法。
本文回顾了双能和多能CT成像的原理、硬件方案及其应用。
基本原理
单能CT研究中组织的分化是基于体素特定的CT值(当然也包括形态)。单能CT测量的是所有组织在一个体素内整个能量范围的累积衰减,而不是在不同的特定能量水平上的响应。以亨斯菲尔德单位定量的CT值通常以不同的灰度显示。然而,不同的材料,如钙和碘,在某些浓度下可能具有相似的CT值,因此在单能CT获取中无法区分这些材料。
一般来说,任何材料的衰减以其CT值表现,基本上是由光电效应和康普顿效应的组合造成的。这两种主要的CT衰减机制都与能量和材料有关。光电效应在低光子能量下占主导地位,并且高度依赖于能量。康普顿散射在超过30 keV的能量下几乎独立于光子能量发生。光电效应与高原子序数有关,而康普顿效应则主要与材料的密度有关。因此,这两种机制在不同的能量水平上的影响各不相同。
双能CT
计算机断层扫描通过分析两种X射线谱来实现材料区分,这种技术称为双能成像,能够分析康普顿效应和光电效应。
在双能CT成像中,选定能量谱的不同衰减值用于材料区分,前提是原子序数和/或质量密度不同。
当原子序数之间存在较大差异时,材料的区分就更为容易。图1展示了碘(高原子序数Z=53)和钙(原子序数Z=12-14)的区分。在两个不同的能量级别上,衰减曲线的差异被放大,从而能够基于两个CT数进行区分。

图1 骨骼、碘和水的特定材料衰减曲线与光子能量绘制在一起。注意80 kVp和140 kVp的碘的光谱平均能量与骨骼之间的衰减差异。
最后,利用双能CT的元素浓度可以通过三种材料分解算法来确定。光谱材料分解在测量三种不同材料的两种材料特定CT数值时是可能的(即两种低Z值材料,例如脂肪和软组织(Z≈6-8),在单能谱中有所不同,以及一种高Z值材料,例如碘(Z=53),在双能谱中可区分)时,这些测量被传入散点图,将低能成像的CT数值放在y轴,高能成像的CT数值放在x轴。这些之前发布的算法会将单个体素几何分解为两种低Z值元素和一种高Z值元素的混合(例如脂肪、软组织和含碘对比剂)。因此考虑到体素的体积守恒或质量守恒,即三种材料的体积/质量之和应等于整个体素的体积/质量。这种方法不仅可以识别单一的高Z值元素,还可以通过光谱材料分解对其进行量化。
多能量CT
多能量CT是一种更具体的材料分解方法,目前尚在研究阶段,尚未投入临床使用。多能量CT的技术与双能量CT不同,它使用超过两种能量(即多种能量)以及狭窄能量范围内的衰减特性。X射线管通常在单一管电压下工作,以产生广泛的光子能量谱。束流的能量带分离发生在探测器内部,该探测器为能量敏感的光子计数探测器。用可见光作类比,这个系统就像用普通相机拍摄彩色玻璃窗的照片。在这个系统中,太阳产生一系列波长(或能量);彩色玻璃窗对照射到透镜的光束进行不同程度的衰减,而相机的电荷耦合器件芯片则将光子分离成红、绿和蓝三个通道。
硬件方法
最早通过利用不同能量光谱的衰减特性来区分材料的尝试可以追溯到上世纪70年代。然而,那个时候早期CT系统的技术缺陷限制了双能量和多能量CT成像在日常临床常规中的应用。
尽管体外结果表现良好,但向体内环境转化的过程中由于配准问题造成了障碍。为了获得两组不同X射线能量光谱的数据,需要通过不同的峰值管电压进行两次采集。这种方法从一开始就带来了显著的空间不匹配风险。此外,X射线管技术在低峰电压下无法提供足够的光子输出,以便在可接受的图像噪声值下进行诊断性体内成像。这两个主要问题——空间不匹配和噪声图像——阻碍了双能量CT成像在临床放射学中的应用;它在许多年里仅仅是一个研究技术。然而,在投影放射摄影中,双能量X射线吸收测量法已成为临床骨密度测量的参考标准。
对于双能量CT,这些问题已经通过现代CT技术得以解决。技术进步不仅改善了时空分辨率,还显著缩短了数据采集时间,同时提高了输出功率容量。目前,来自不同厂商的CT系统能够通过评估材料在两种不同能量光谱下的衰减特性来实现双能量材料分解。
双能CT
为获取双能数据,许多不同的硬件方案已被各个厂商提出和追求:
(1)
快速kVp切换(GE医疗,密尔沃基,威斯康星州)
(2)
能量敏感型夹心探测器(飞利浦医疗系统,克利夫兰,俄亥俄州)以及
(3)
双源CT(西门子医疗,福尔茨海姆,德国)
快速kVp切换
在快速kVp切换中,X射线管快速调节管电压,从而产生低中能量和高中能量的光谱及峰值能量。图2
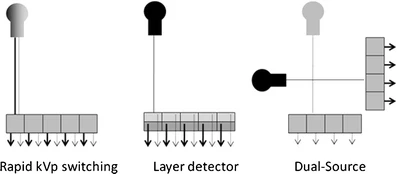
双能CT成像不同硬件方案的示意图。在快速kVp切换中,X射线管电压迅速调至不同的kVp水平,从而产生低能和高能的光谱(左侧)。能量敏感层探测器叠加在另一层上(中间)。上层探测器吸收低能X射线光子,而下层探测器则检测高能X射线光子。双源CT方案则使用两个X射线管和对应的探测器,按一定角度偏移排列(右侧)。两个X射线管在不同的kVp水平下工作,实现同时的双能数据采集。
这个切换过程需要将每次旋转的投影数量加倍,以保持足够的数据用于图像重建。
能量敏感的夹层探测器技术采用分层探测器设计(见图2)。两个探测器相互重叠,由不同的材料组成。顶层探测器吸收低能量的X射线光子,而底层探测器检测高能量的X射线光子。与快速kVp切换类似,低高管电压输出受限于相同的过滤器。
双源CT
第三种硬件方法是双源CT。双源CT由两个X射线管和两个探测器组成,这些探测器以角度偏移的方式排列在旋转装置上(见图2)。这种配置使得以高时间分辨率评估冠状动脉成为可能,或用于获取双能量CT数据。当两个X射线管以不同的管电压操作时,会同时获得两种不同的X射线谱,从而产生双能量组织特征。双源双能量CT方法的优点在于能够为每个kVp等级单独调整管电流,这样两个数据集的噪声水平就能保持相似。由于管-探测器组合的角度偏移,双能量处理必须在图像空间中进行。
当前的局限性在考虑以下几个方面时最容易理解。一般来说,当使用的两个能谱之间重叠较少时,双能量CT对材料的区分效果特别好。然而,由于CT中的管电压仅反映X射线光子的峰值能量,因此会出现光谱重叠。最后,由于探测器尺寸较小,第一代双源CT的成像视场被限制在中央26厘米,这阻碍了对外周身体部位的成像。
这些局限性在第二代双源CT中得到了改善,从而提升了双能量成像的能力。这种CT可以选择性地配备光子屏蔽,采用安装在高能X射线管前的锡滤光器。这种滤光器改善了两个能谱(即80和140 kVp)的分离,同时显著提高了区分能力。另一方面,当低kVp水平从80提高到100时,可以显著降低图像噪声,而不会影响区分能力。为了减少辐射剂量,研究人员评估了特定的低剂量双能量协议,其范围在单能量获取的范围内。最后,成像视场扩展到33厘米,使得在x和y方向上的覆盖面积更大。
多能量CT
最新的多能量CT系统使用光子计数探测器,从而在每幅图像中获取多个X射线能量水平。这类图像通常被称为光谱CT。光子计数探测器技术可以将单个X射线光子直接转换为半导体层中的电离云。探测器的电子元件接着测量每个光子带来的能量,并对与该能量相关的计数器进行增量计数。也就是说,光子计数探测器会在设定的能量范围内计数单个X射线光子,这些范围也被称为箱或阈值。目前的探测器可能有多达八个能量阈值。
使用能量敏感光子计数探测器的CT的优点包括:(1)每个能量都是同时获取的,因此不同能量间不存在配准问题。(2)能量范围之间没有重叠。(3)可以定义任意能量范围,优化软件以发现成像问题。(4)只要电子设备有足够的空间,就可以记录尽可能多的能量水平。
由欧洲核子研究组织(CERN)主办的Medipix合作项目对他们的发展进行了广泛的宣传,最近一些主要设备制造商也宣布了相关项目。
成像应用
据我们所知,最近关于双能量CT的出版物大多采用了双源法。下面介绍了一些临床相关的双能量CT应用。此外,为了了解多能量CT的发展方向,我们将看一下临床前研究实验室。正在开发的应用包括多对比成像、新的对比剂和动脉粥样硬化斑块特征化。
双能量CT
目前的双能量CT应用可以分为两大类:
(1)
材料的区分
(2)
对比材料的识别和定量
材料的区分
两种不同材料的识别基本上使它们能够被区分(参见上面关于基本原理的双能CT部分)。
利用关于钙和碘的特定材料信息,我们不仅可以识别,还能在CT血管造影中区分这两种材料。这使得基于双能的后处理技术成为可能。骨骼去除可以基于双能信息自动化,而不需要依赖传统算法(例如区域生长)。在与血管区域和骨骼紧密相邻的复杂解剖区域(如威利斯环和颅骨(图3))以及外周动脉和附肢骨骼中,这种应用可能是一种节省时间的替代方法。
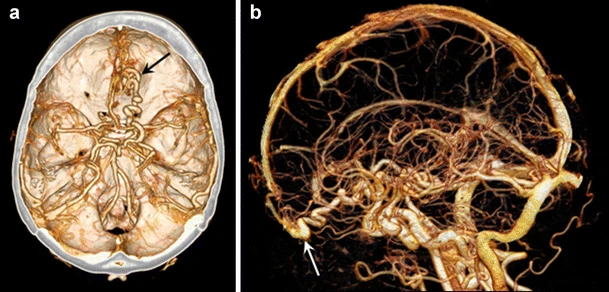
图3 双能量颅脑CT血管造影的体积渲染显示了右额叶的动静脉畸形(A,黑箭头)。自动骨骼去除通过双能量(B)被精确实现,从而更好地显示出畸形及其向上矢状窦的引流。
由于可以精准地从图像中去除骨骼,骨髓可能会变得可供CT诊断评估。最近,这些“虚拟非钙图像”被用来检测受伤的骨髓。与磁共振成像相比,双能CT能够评估骨髓,使得双能CT成为评估膝关节外伤后骨挫伤的潜在有价值工具。
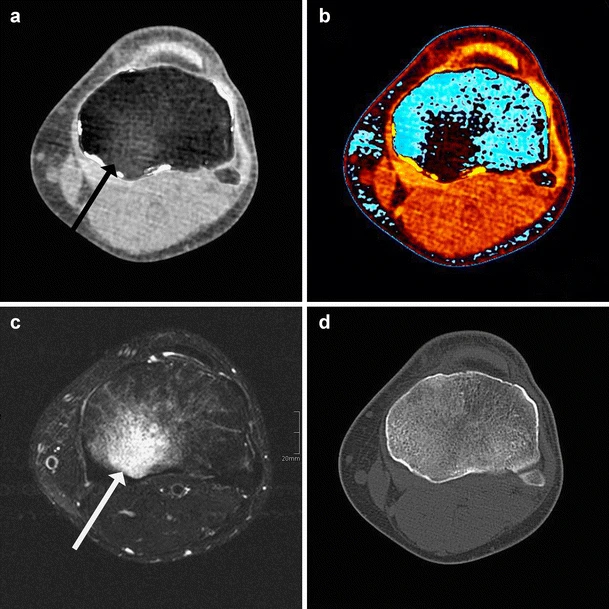
图4 双能量CT虚拟非钙灰度图像(A)和彩色编码图像(B)清晰地显示了创伤后骨挫伤,经过T2加权磁共振成像(C)证实。注意骨结构完好(D)。
不仅是骨骼,使用双能量CT也可以从动脉中去除钙化斑块。这项技术在血管模型中证明是适用的。对于钙化斑块,这种自动斑块去除的准确性很高,但在低密度钙化斑块、低管腔增强和小血管直径时准确性较低。然而,当应用于体内血管成像时,研究人员发现去除斑块后的双能量CT狭窄分级与颈动脉的数字减影血管造影有很好的一致性。
根据区分钙(低Z数)和碘(高Z数)的相同原理,双能量CT可以识别尿酸。这在泌尿结石病的检查中起到辅助作用,因为含尿酸的尿路结石可以与其他不含尿酸的成分的结石区分开。这对临床管理有影响,因为在尿酸存在时,可以通过药物治疗来碱化尿液。多项研究已在体外和体内进行,以评估这一应用,得到的敏感性范围为88%到100%,特异性范围为98%到100%。此外,将这一尿酸识别算法转移到肌肉骨骼成像中对痛风石的诊断也有帮助。
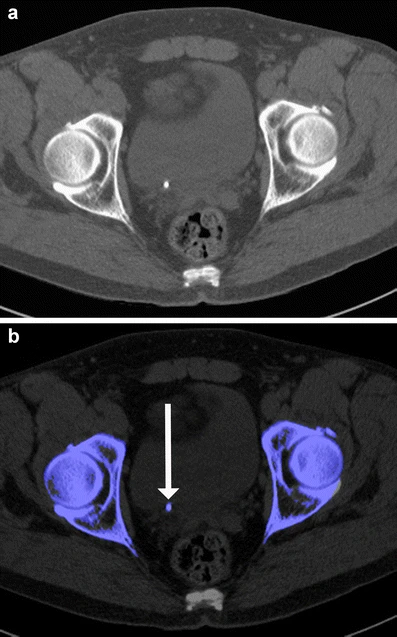
图5 非对比增强的腹部双能CT准确显示右侧远端输尿管的尿石(A)。双能后处理显示石头完全由非尿酸成分组成,这通过蓝色编码表示(B,箭头)。石头的各个部分都不包含尿酸(红色编码,未显示)。
对比剂的识别和量化
双能CT的一大主要优势是,80 kVp时的碘的衰减系数大约是140 kVp时的两倍。这种低kVp图像的对比度提升被证明有助于提高血管化腹部脏器病变的清晰度,而不依赖于双能分析。
对比剂的识别不仅有助于其量化(见上面关于双能CT的基本原理部分),还包括其减法处理。通过从增强对比图像中减去碘化对比剂,生成一个虚拟的非增强图像。这个应用降低了辐射剂量,并避免了后续的非增强扫描。研究表明,虚拟非增强图像可以作为标准非增强扫描的可接受替代,适用于肾脏/肾上腺和肝脏影像的后续检查,包括血管内主动脉瘤修复的随访、尿路结石疾病的检测以及颅内CT血管造影中颅内出血的检测。根据使用的协议,当省去非增强CT时,辐射剂量最多可以减少50%。
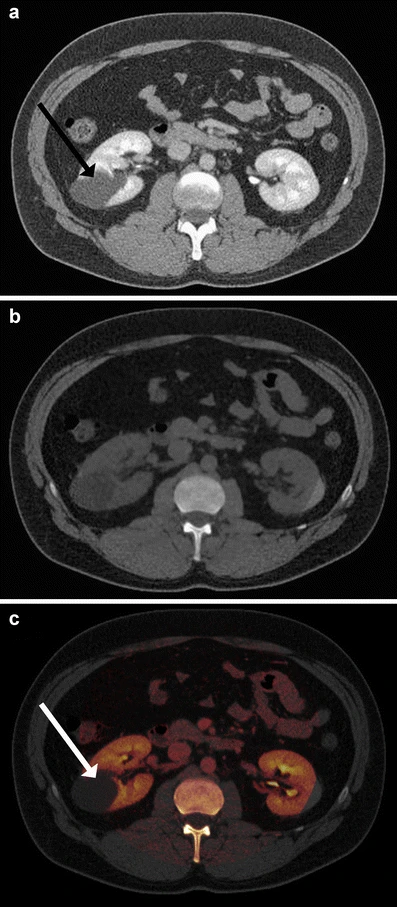
图6 加权双能图像(A)是在低和高kVp图像之间的平均值,外观上类似于传统的单能CT图像。双能衍生的材料特定信息用于量化对比剂,从而允许其被减去以生成虚拟非增强图像(B)。碘图显示了叠加在灰度CT上的对比剂含量(C)。请注意加权双能图像与虚拟非增强图像以及碘图的比较,这有助于在单个阶段获取中检测或排除增强(见肾囊肿,箭头)。
另一方面,造影剂的量化使得能够以颜色编码的方式显示其元素碘的浓度(见图6)。这种显示技术已用于肾上腺和肾脏病变的特征化。在一项评估肾囊肿和增强肿块的虚拟研究中,当使用碘覆盖技术时,区分的准确性极高。在一项病人研究中,研究人员应用双能CT对肾脏肿块进行特征化,并展示了在经历单次肾脏成像阶段采集后,双能CT能在约95%的患者中正确识别良性和恶性疾病(见图6)。
基于双能的碘分布图也允许与单光子发射CT相比,对心脏“灌注”缺陷进行准确评估。双能CT可以描绘出肺灌注的局部变化,尤其是在患有肺气肿的患者身上(图7)。同样,在怀疑有肺栓塞的患者中,多项研究表明,通过显示肺实质中的碘分布,可以改善肺栓塞的诊断。
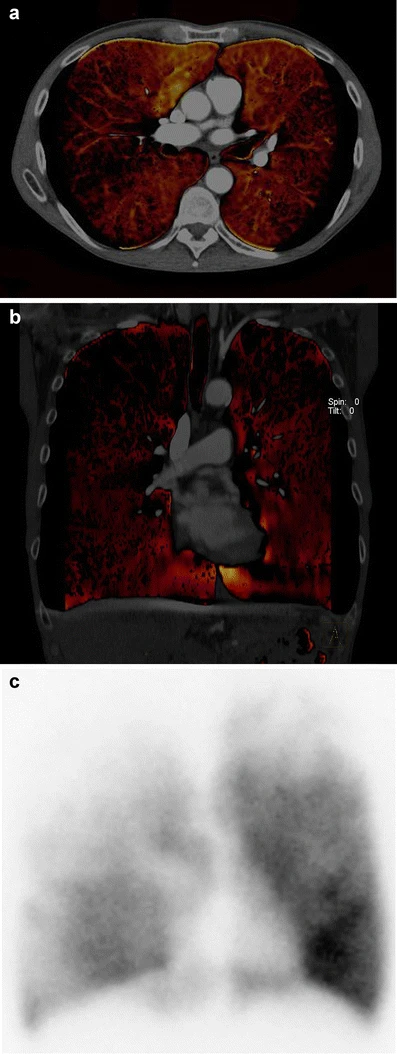
图7 肺部双能CT血管成像可以评估肺气肿患者的肺灌注情况。注意到不均匀的灌注模式,主要集中在右上叶,这在横断面(A)和冠状面(B)的双能CT重建中得到了很好的展示,并与灌注显像(C)相吻合。
除了通过碘造影剂定量评估肺灌注外,双能CT还可以通过检测氙气来评估肺通气。在吸入过程中对氙气的检测能够准确评估动态和静态的区域通气。因此,双能CT在数据采集时显著减少了肺容量差异的影响,相比于单能CT。双能CT提供的通气功能信息与从同一数据集中生成的薄层CT图像完全一致。
碘差的测量也可能为局部和抗血管生成治疗后的肿瘤监测提供帮助。然而,目前尚无科学研究可供参考;我们在检测肝细胞癌复发方面的初步经验是有希望的。
多能CT
多能CT的临床前应用正在研究实验室中进行研究。
其中一组应用依赖于多种造影剂的k边缘。这种k边缘代表了一个元素在特定能量上的衰减的跃变。谱内特定能级上的衰减增加对应于k壳层电子的结合能,超出该结合能时会发生光电吸收。识别k边缘的能力使多能CT能够测量诊断能量范围内具有k边缘的任何元素,从而能够同时区分多种高原子序数的元素。通常这些重元素是碘、钡、钆、金和铂。
多对比k边缘成像在小鼠身上已得到验证。特别是碘、钡和背景组织可以在小鼠组织中作为不同材料单独识别。这意味着在检查的不同时间点可以给予多种放射性对比材料,但可以在单一相位进行成像。换句话说,造影剂A可以在多能CT前15分钟给予,造影剂B可以在30秒前给予。成像后,使用类似于虚拟无对比增强研究的原理,可以向放射科医生呈现多个对比相位,即无对比相(去除造影剂A和造影剂B)、延迟相(去除造影剂B)和门静脉相(去除造影剂A)。因此,可以在单次检查中进行三相肾脏或肝脏研究,减少剂量,消除病人运动并提高病人处理效率。

图 8多能量CT可以区分小鼠体内的碘、铋和骨骼。单能量图像显示碘、铋和骨骼的衰减值相似,在能量大于23 keV时无法根据CT数值进行区分(A)。多能量CT数据可以在横断面图像(B)和体积渲染CT图像(C)上区分循环中的碘(红色编码)、肺部的铋(黄色)和骨骼(白色)。注意,碘和铋的Z值都很高,仅通过k边缘相差4 keV来区分。左下支气管(LLB)、左下肺叶(LLL)、肺动脉干(PA)、右心房(RA)、右下肺叶(RLL)、右心室(RV)。
识别重元素的能力促进了新型造影剂的发展。许多研究小组一直在研究金标功能纳米颗粒。因此,多能量CT成像可以实现功能成像,因为金标颗粒可以靶向特定的酶或细胞。使用k-edge成像技术,可以量化颗粒的数量和位置,即使在存在其他造影剂如碘或钆的情况下也是如此。
最后但同样重要的是,多能量CT成像提供了更好的组织内在对比度以表征组织。一个重要的例子是动脉粥样硬化斑块的表征,其中希望识别铁和钙以确定斑块破裂的风险。
